- Expresión: nuclear.
- Tinción en tejidos normales: La máxima expresión se encuentra en las células glandulares de apéndice, colon y recto. También tiñen algunas neuronas de la corteza frontal e hipocampo, y los osteoblastos. Hay una expresión más moderada en algunas células de testículo y epidídimo.
- Utilidad principal: marcador sensible de origen colorrectal en adenocarcinomas.
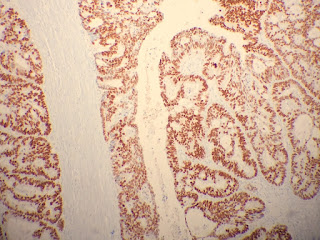 |
| SATB2 en un caso nuestro de adenocarcinoma de colon |
- Sensibilidad y especificidad:
Es
un marcador más
sensible que específico:
El principal estudio es el de Magnusson, que
refiere expresión
de SATB2 en 97.4% de las muestras de mucosa colónica normal, 98.9%
de adenomas de colon y 85.8 a 81.3% de carcinomas colorrectales
dependiendo del estadio y grado del tumor.
Si se combina la expresión de SATB2 con la de
CK20, es capaz de identificar más del 95% de todos los carcinomas
colorrectales, incluyendo la mayoría de los pobremente diferenciados
y los carcinomas medulares.
Otra serie importante es la de Dragomir et al.
Analizaron 840 casos y encontraron una elevada sensibilidad (93%) y
especificidad (77%) para SATB2 como marcador de origen colorrectal, y
si se combinaba con CK7 y CK20, la especificidad se incrementaba
hasta el 100%.
Sobre la especifidad, en las dos series
mencionadas se ha descrito positividad para SATB2 en algunos casos de
otras neoplasias:
Mama (4%), ovario
(3%), adenocarcinoma pulmonar (3 o 5.7%), carcinoma epidermoide de
pulmón (10.7%), carcinoma renal de células claras de alto grado
(7.9%), carcinoma papillar de células renales (18.8%),
adenocarcinoma endocervical (9%), adenocarcinoma endometrial (3.8%),
carcinoma urotelial de vejiga (20.9%), colangiocarcinomas (6.7%),
adenocarcinoma de esófago (6.7%), adenocarcinoma de páncreas
(4,2%), carcinomas nasosinusales (55,6%) e incluso angiosarcomas
(8.6%). No hubo positividad en ninguno de los casos estudiados de
adenocarcinoma de estómago y de próstata.
Una
de las aplicaciones que se ha sugerido para este anticuerpo es
diferenciar primario vs metástasis ante una neoplasia mucinosa de
tipo intestinal en el ovario (además de otros datos que se vienen
utilizando tradicionalmente para este diagnóstico diferencial).
Sólo
a título de curiosidad (porque son pocos casos), en las pruebas que
hemos hecho en bloques multitejido que
incluían 51 casos de nuestro hospital,
fueron positivos para SATB2
los 6 adenocarcinomas de colon estudiados (uno de ellos, con
intensidad moderada). Vimos que la tinción puede variar de
intensidad en diferentes áreas del tumor y que, a veces, hay
tinciones citoplasmáticas (que no hay que valorar). Otros tumores
que resultaron positivos para SATB2 fueron: un adenocarcinoma de
vesícula biliar, un carcinoide ovárico, y, débilmente, un oat cell
de pulmón. Los otros 42 tumores fueron negativos.
-
Otras aplicaciones:
- SATB2 podría ser de cierta ayuda para establecer el origen de
tumores neuroendocrinos (NET):
Es
positivo en un 90% de los NET de colon izquierdo y recto, mientras
que menos frecuente en otros orígenes,
ya sea en el tracto gastrointestinal (9% de los gástricos, 8% de los
duodenales y los de íleon, 25% de los de apéndice, 20% de los de
ciego y colon ascendente), páncreas (15%) o pulmón (23%). La
especificidad de origen no es, pues, del 100% y hay que usarlo en
combinación con otros marcadores (como TTF1, CDX2 y PAX8).
-SATB2 es además un marcador de diferenciación osteoblástica, en tumores mesenquimales y óseos, tanto benignos como malignos.
-SATB2 es además un marcador de diferenciación osteoblástica, en tumores mesenquimales y óseos, tanto benignos como malignos.
-
Hay que tener cuidado con la positividad en los osteoblastos normales para no cometer errores de interpretación en el estudio histológico de carcinomas metastásicos en el hueso.
Bibliografía
Magnusson. AJSP 2011.
Conner. Histopathol 2013.
Dragomir. Am J Clin
Pathol 2014.
Lin. Arch Pathol Lab Med
2014.
Pérez Montiel. Ann Diag
Pathol 2015.
Li. Int J Clin Exp Pathol
2015.
Brocato. Carcinogenesis
2015.