Aquí tenéis información sobre uso del anticuerpo WT1:
https://www.dropbox.com/s/hv4xdc2hhaal0v1/WT1.ppt?dl=0
martes, 20 de octubre de 2015
martes, 22 de septiembre de 2015
SATB2
- Expresión: nuclear.
- Tinción en tejidos normales: La máxima expresión se encuentra en las células glandulares de apéndice, colon y recto. También tiñen algunas neuronas de la corteza frontal e hipocampo, y los osteoblastos. Hay una expresión más moderada en algunas células de testículo y epidídimo.
- Utilidad principal: marcador sensible de origen colorrectal en adenocarcinomas.
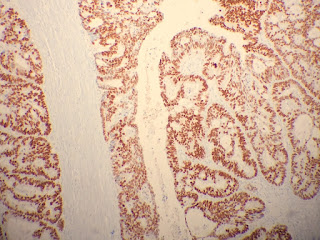 |
| SATB2 en un caso nuestro de adenocarcinoma de colon |
- Sensibilidad y especificidad:
Es
un marcador más
sensible que específico:
El principal estudio es el de Magnusson, que
refiere expresión
de SATB2 en 97.4% de las muestras de mucosa colónica normal, 98.9%
de adenomas de colon y 85.8 a 81.3% de carcinomas colorrectales
dependiendo del estadio y grado del tumor.
Si se combina la expresión de SATB2 con la de
CK20, es capaz de identificar más del 95% de todos los carcinomas
colorrectales, incluyendo la mayoría de los pobremente diferenciados
y los carcinomas medulares.
Otra serie importante es la de Dragomir et al.
Analizaron 840 casos y encontraron una elevada sensibilidad (93%) y
especificidad (77%) para SATB2 como marcador de origen colorrectal, y
si se combinaba con CK7 y CK20, la especificidad se incrementaba
hasta el 100%.
Sobre la especifidad, en las dos series
mencionadas se ha descrito positividad para SATB2 en algunos casos de
otras neoplasias:
Mama (4%), ovario
(3%), adenocarcinoma pulmonar (3 o 5.7%), carcinoma epidermoide de
pulmón (10.7%), carcinoma renal de células claras de alto grado
(7.9%), carcinoma papillar de células renales (18.8%),
adenocarcinoma endocervical (9%), adenocarcinoma endometrial (3.8%),
carcinoma urotelial de vejiga (20.9%), colangiocarcinomas (6.7%),
adenocarcinoma de esófago (6.7%), adenocarcinoma de páncreas
(4,2%), carcinomas nasosinusales (55,6%) e incluso angiosarcomas
(8.6%). No hubo positividad en ninguno de los casos estudiados de
adenocarcinoma de estómago y de próstata.
Una
de las aplicaciones que se ha sugerido para este anticuerpo es
diferenciar primario vs metástasis ante una neoplasia mucinosa de
tipo intestinal en el ovario (además de otros datos que se vienen
utilizando tradicionalmente para este diagnóstico diferencial).
Sólo
a título de curiosidad (porque son pocos casos), en las pruebas que
hemos hecho en bloques multitejido que
incluían 51 casos de nuestro hospital,
fueron positivos para SATB2
los 6 adenocarcinomas de colon estudiados (uno de ellos, con
intensidad moderada). Vimos que la tinción puede variar de
intensidad en diferentes áreas del tumor y que, a veces, hay
tinciones citoplasmáticas (que no hay que valorar). Otros tumores
que resultaron positivos para SATB2 fueron: un adenocarcinoma de
vesícula biliar, un carcinoide ovárico, y, débilmente, un oat cell
de pulmón. Los otros 42 tumores fueron negativos.
-
Otras aplicaciones:
- SATB2 podría ser de cierta ayuda para establecer el origen de
tumores neuroendocrinos (NET):
Es
positivo en un 90% de los NET de colon izquierdo y recto, mientras
que menos frecuente en otros orígenes,
ya sea en el tracto gastrointestinal (9% de los gástricos, 8% de los
duodenales y los de íleon, 25% de los de apéndice, 20% de los de
ciego y colon ascendente), páncreas (15%) o pulmón (23%). La
especificidad de origen no es, pues, del 100% y hay que usarlo en
combinación con otros marcadores (como TTF1, CDX2 y PAX8).
-SATB2 es además un marcador de diferenciación osteoblástica, en tumores mesenquimales y óseos, tanto benignos como malignos.
-SATB2 es además un marcador de diferenciación osteoblástica, en tumores mesenquimales y óseos, tanto benignos como malignos.
-
Hay que tener cuidado con la positividad en los osteoblastos normales para no cometer errores de interpretación en el estudio histológico de carcinomas metastásicos en el hueso.
Bibliografía
Magnusson. AJSP 2011.
Conner. Histopathol 2013.
Dragomir. Am J Clin
Pathol 2014.
Lin. Arch Pathol Lab Med
2014.
Pérez Montiel. Ann Diag
Pathol 2015.
Li. Int J Clin Exp Pathol
2015.
Brocato. Carcinogenesis
2015.
martes, 8 de septiembre de 2015
ARG-1
ARGINASA-1
*Aplicación:
La Arginasa-1 (Arg-1) es un nuevo marcador de IHQ, aparentemente prometedor, que sirve para demostrar el origen hepatocelular de un carcinoma: algunos lo consideran de elección para este fin, por su gran sensibilidad (en una revisión de 6 estudios que agrupan 511 hepatocarcinomas, el 91% expresaban Arg-1); y muy alta especificidad (Chan 2013, Ordóñez 2014).
La arginasa es una enzima que existe en dos isoformas: una hepática (la Arg-1) y otra extrahepática (la Arg-2). La Arg-1 tiene un papel clave en el ciclo de la urea del hígado y se expresa en los hepatocitos normales y sus tumores. (Por cierto, el antígeno hepatocitario que se tiñe con el anticuerpo Hep Par 1, que usamos con más frecuencia, es también un enzima implicado en la producción de urea).
La tinción IHQ para Arg-1 es difusa citoplasmática y, a veces, también nuclear, en todos los hepatocitos del lobulillo, y no se observa en las otras células del hígado (Yan 2010). Sólo la tinción citoplasmática se considera positividad (se desconoce el significado de la nuclear, aunque puede ocurrir, como en los casos que hemos probado nosotros) (Yan 2010, Timek 2012).
Una cosa a recordar es que Arg-1 es sólo un marcador de origen pero no sirve para diferenciar benignidad de malignidad (para esto, en el hígado, el glipicano-3, que, por cierto, no es específico de origen y se ve en una variedad de neoplasias).
* Sensibilidad:
La ventaja de Arg-1 sobre el más conocido antígeno hepatocitario o Hep Par1, es que resulta más sensible (en una revisión de 6 estudios, incluyendo un total de 471 hepatocarcinomas (HCC): 91% frente al 75%). La mayor ventaja en la sensibilidad se observó en los hepatocarcinomas moderada y pobremente diferenciados que son positivos respectivamente: 96% para Arg-1 y 83% para Hep-Par1 los primeros; y 86% para Arg-1 vs. 46% para Hep-Par1 los poco diferenciados (Yan 2010). En este estudio no hubo ningún caso que fuera positivo para Hep-Par 1 y negativo para Arg-1, por lo que sugieren que este marcador podría sustituír al anterior. Los resultados son distintos, sin embargo, en el estudio de Timek, sobre bloques citológicos de PAAF de 29 HCC: encuentra algo más de sensibilidad para HepPar-1 (83% vs. 79% para Arg-1), quizás debido al tamaño de la muestra, siendo la positividad en proporciones similares para ambos (91%) en los bien diferenciados, mientras que de 7 HCC poco diferenciados 3 eran positivos para Arg-1 y 4 para HepPar-1. Encuentran además 3 casos que fueron positivos para HepPar-1 pero fueron negativos para Arg-1, por lo que son partidarios de usar los dos conjuntamente (y junto con glipicano), al igual que otros autores (Chen 2014).
*Especificidad:
Arg-1 se considera más específico que HepPar1: de 738 tumores malignos no HCC, sólo se tiñeron con Arg-1 un adenocarcinoma prostático de 15 analizados, y un colangiocarcinoma de forma débil y focal, de los 6 analizados; mientras que 22 tumores no HCC fueron Hep Par 1 positivos (entre ellos destacan 9 adenocarcinomas gástricos de 19 estudiados) (Yan 2010, Ordoñez 2014).
Se ha comunicado algún caso positivo para Arg-1 de adenocarcinoma de páncreas (3 de 15 casos: 20%), aunque esto no se observó en ninguno de los 50 casos de otro estudio; y también casos aislados de carcinoma de mama, colon y endometrio , generalmente con una tinción débil y focal (Ordoñez 2014).
En otro trabajo en que se analizaron más de 1200 tumores no HCC (incluyendo 136 adenocarcinomas prostáticos) ninguno expresó Arg-1 mientras que 2.7% fueron positivos para Hep Par 1 (Timek 2012).
La especificidad de Arg-1 es, pues, muy elevada (casi el 100%), mientras que Hep Par 1 se ha descrito con cierta frecuencia en tumores no HCC, el más frecuente el adenocarcinoma gástrico (12 a 47 % según los trabajos), algunos casos de adenocarcinoma de pulmón (6 a 24 %), carcinomas esofágicos (27%), adenomas y adenocarcinomas de colon (4-12%), páncreas (2-10%), vesícula biliar (25%), colangiocarcinomas (7 a 30%), carcinomas de corteza adrenal (20%) y algún carcinoma renal cromófobo (Kakar 2007, Yan 2010, Ordóñez 2014).
Se ha señalado, como característica especialmente valiosa, que no hay casos comunicados en la literatura de carcinomas hepatoides positivos para Arg-1 (Chen 2014).
* Otros tumores hepáticos:
En la variante de hepatocarcinoma escirro la diferencia de sensibilidad con Hep Par 1 es aún más evidente, puesto que los HCC escirros suelen ser negativos para Hep Par 1 (y pueden expresar CK7, lo que dificulta aún más el diagnóstico). En 13 casos analizados: 85% de los casos son positivos para Arg-1, mientras que el 26% lo son para Hep Par 1, así que los marcadores más útiles para este tumor parecen ser Arg-1 junto con glipicano 3 (Krings 2013).
Los hepatoblastomas son también positivos para Arg-1, sobre todo en el componente fetal (Chen 2014).
*Técnica:
Los anticuerpos anti Arg-1 más referenciados en la literatura son policlonales (HPA003595 de conejo de Sigma y H-52 de Santa Cruz) y el monoclonal EPR6672(B). Nosotros estamos utilizando el anticuerpo monoclonal SP156.
*Aplicación:
La Arginasa-1 (Arg-1) es un nuevo marcador de IHQ, aparentemente prometedor, que sirve para demostrar el origen hepatocelular de un carcinoma: algunos lo consideran de elección para este fin, por su gran sensibilidad (en una revisión de 6 estudios que agrupan 511 hepatocarcinomas, el 91% expresaban Arg-1); y muy alta especificidad (Chan 2013, Ordóñez 2014).
La arginasa es una enzima que existe en dos isoformas: una hepática (la Arg-1) y otra extrahepática (la Arg-2). La Arg-1 tiene un papel clave en el ciclo de la urea del hígado y se expresa en los hepatocitos normales y sus tumores. (Por cierto, el antígeno hepatocitario que se tiñe con el anticuerpo Hep Par 1, que usamos con más frecuencia, es también un enzima implicado en la producción de urea).
La tinción IHQ para Arg-1 es difusa citoplasmática y, a veces, también nuclear, en todos los hepatocitos del lobulillo, y no se observa en las otras células del hígado (Yan 2010). Sólo la tinción citoplasmática se considera positividad (se desconoce el significado de la nuclear, aunque puede ocurrir, como en los casos que hemos probado nosotros) (Yan 2010, Timek 2012).
Una cosa a recordar es que Arg-1 es sólo un marcador de origen pero no sirve para diferenciar benignidad de malignidad (para esto, en el hígado, el glipicano-3, que, por cierto, no es específico de origen y se ve en una variedad de neoplasias).
* Sensibilidad:
La ventaja de Arg-1 sobre el más conocido antígeno hepatocitario o Hep Par1, es que resulta más sensible (en una revisión de 6 estudios, incluyendo un total de 471 hepatocarcinomas (HCC): 91% frente al 75%). La mayor ventaja en la sensibilidad se observó en los hepatocarcinomas moderada y pobremente diferenciados que son positivos respectivamente: 96% para Arg-1 y 83% para Hep-Par1 los primeros; y 86% para Arg-1 vs. 46% para Hep-Par1 los poco diferenciados (Yan 2010). En este estudio no hubo ningún caso que fuera positivo para Hep-Par 1 y negativo para Arg-1, por lo que sugieren que este marcador podría sustituír al anterior. Los resultados son distintos, sin embargo, en el estudio de Timek, sobre bloques citológicos de PAAF de 29 HCC: encuentra algo más de sensibilidad para HepPar-1 (83% vs. 79% para Arg-1), quizás debido al tamaño de la muestra, siendo la positividad en proporciones similares para ambos (91%) en los bien diferenciados, mientras que de 7 HCC poco diferenciados 3 eran positivos para Arg-1 y 4 para HepPar-1. Encuentran además 3 casos que fueron positivos para HepPar-1 pero fueron negativos para Arg-1, por lo que son partidarios de usar los dos conjuntamente (y junto con glipicano), al igual que otros autores (Chen 2014).
*Especificidad:
Arg-1 se considera más específico que HepPar1: de 738 tumores malignos no HCC, sólo se tiñeron con Arg-1 un adenocarcinoma prostático de 15 analizados, y un colangiocarcinoma de forma débil y focal, de los 6 analizados; mientras que 22 tumores no HCC fueron Hep Par 1 positivos (entre ellos destacan 9 adenocarcinomas gástricos de 19 estudiados) (Yan 2010, Ordoñez 2014).
Se ha comunicado algún caso positivo para Arg-1 de adenocarcinoma de páncreas (3 de 15 casos: 20%), aunque esto no se observó en ninguno de los 50 casos de otro estudio; y también casos aislados de carcinoma de mama, colon y endometrio , generalmente con una tinción débil y focal (Ordoñez 2014).
En otro trabajo en que se analizaron más de 1200 tumores no HCC (incluyendo 136 adenocarcinomas prostáticos) ninguno expresó Arg-1 mientras que 2.7% fueron positivos para Hep Par 1 (Timek 2012).
La especificidad de Arg-1 es, pues, muy elevada (casi el 100%), mientras que Hep Par 1 se ha descrito con cierta frecuencia en tumores no HCC, el más frecuente el adenocarcinoma gástrico (12 a 47 % según los trabajos), algunos casos de adenocarcinoma de pulmón (6 a 24 %), carcinomas esofágicos (27%), adenomas y adenocarcinomas de colon (4-12%), páncreas (2-10%), vesícula biliar (25%), colangiocarcinomas (7 a 30%), carcinomas de corteza adrenal (20%) y algún carcinoma renal cromófobo (Kakar 2007, Yan 2010, Ordóñez 2014).
Se ha señalado, como característica especialmente valiosa, que no hay casos comunicados en la literatura de carcinomas hepatoides positivos para Arg-1 (Chen 2014).
* Otros tumores hepáticos:
En la variante de hepatocarcinoma escirro la diferencia de sensibilidad con Hep Par 1 es aún más evidente, puesto que los HCC escirros suelen ser negativos para Hep Par 1 (y pueden expresar CK7, lo que dificulta aún más el diagnóstico). En 13 casos analizados: 85% de los casos son positivos para Arg-1, mientras que el 26% lo son para Hep Par 1, así que los marcadores más útiles para este tumor parecen ser Arg-1 junto con glipicano 3 (Krings 2013).
Los hepatoblastomas son también positivos para Arg-1, sobre todo en el componente fetal (Chen 2014).
*Técnica:
Los anticuerpos anti Arg-1 más referenciados en la literatura son policlonales (HPA003595 de conejo de Sigma y H-52 de Santa Cruz) y el monoclonal EPR6672(B). Nosotros estamos utilizando el anticuerpo monoclonal SP156.
miércoles, 13 de mayo de 2015
STAT6.
* Utilidad: Marcador altamente específico y sensible de TUMOR FIBROSO SOLITARIO (TFS).
* Tinción: Nuclear.
* Concepto: Las proteínas STAT son factores de transcripción que se localizan en el citoplasma en estado latente. Cuando se fosforilan y se activan pasan al núcleo. STAT6 también se "recoloca" en el núcleo cuando se produce la fusión NAB2-STAT6, que ocurre en la mayoría de los tumores fibrosos solitarios 855-100%) independientemente de su morfología o localización. Mediante IHQ se puede detectar la expresión nuclear de STAT6.
* Sensibilidad y especificidad: Muy elevadas. Varían según el tipo de anticuerpo usado, y han mejorado con el anticuerpo monoclonal de conejo que nosotros usamos (clon YE361): 100% de sensibilidad en 82 casos de TFS (54 del grupo de Cheah, de la Cleveland clinic, y 28 de la serie de Vogels), y 100% de especificidad, también en las dos series.
(Con otro anticuerpo, policlonal, había sido algo menor la sensibilidad (98%) y la especificidad (fueron también positivos 3 de 21 liposarcomas desdiferenciados, y 1 de 10 fibrohistiocitomas benignos, y en 3 de 90 meningiomas y uno de 4 sarcomas meníngeos.) Estas positividades "indeseables" no se observaron, como hemos dicho, con el anticuerpo monoclonal que tenemos.
* Aplicaciones: Para el diagnóstico de TFS CD34 negativo, o malignos/desdiferenciados; para el diagnóstico diferencial ante otros tumores de partes blandas CD34+ (lipoma fusocelular, miofibroblastoma de tipo mamario, angiofibroma celular, dermatofibrosarcoma protuberans), en ambos casos especialmente en biopsias pequeñas o por aguja; para el diagnóstico diferencial de tumores meníngeos (y la expresión de STAT6 ha reforzado la idea de que TFS y hemangiopericitoma meníngeos se encuadran en la misma entidad).
Bibliografía:
Cheah, Pathology 2014
Doyle, Mod Pathol 2014
Vogels, Diag Pathol 2014
* Tinción: Nuclear.
* Concepto: Las proteínas STAT son factores de transcripción que se localizan en el citoplasma en estado latente. Cuando se fosforilan y se activan pasan al núcleo. STAT6 también se "recoloca" en el núcleo cuando se produce la fusión NAB2-STAT6, que ocurre en la mayoría de los tumores fibrosos solitarios 855-100%) independientemente de su morfología o localización. Mediante IHQ se puede detectar la expresión nuclear de STAT6.
* Sensibilidad y especificidad: Muy elevadas. Varían según el tipo de anticuerpo usado, y han mejorado con el anticuerpo monoclonal de conejo que nosotros usamos (clon YE361): 100% de sensibilidad en 82 casos de TFS (54 del grupo de Cheah, de la Cleveland clinic, y 28 de la serie de Vogels), y 100% de especificidad, también en las dos series.
(Con otro anticuerpo, policlonal, había sido algo menor la sensibilidad (98%) y la especificidad (fueron también positivos 3 de 21 liposarcomas desdiferenciados, y 1 de 10 fibrohistiocitomas benignos, y en 3 de 90 meningiomas y uno de 4 sarcomas meníngeos.) Estas positividades "indeseables" no se observaron, como hemos dicho, con el anticuerpo monoclonal que tenemos.
* Aplicaciones: Para el diagnóstico de TFS CD34 negativo, o malignos/desdiferenciados; para el diagnóstico diferencial ante otros tumores de partes blandas CD34+ (lipoma fusocelular, miofibroblastoma de tipo mamario, angiofibroma celular, dermatofibrosarcoma protuberans), en ambos casos especialmente en biopsias pequeñas o por aguja; para el diagnóstico diferencial de tumores meníngeos (y la expresión de STAT6 ha reforzado la idea de que TFS y hemangiopericitoma meníngeos se encuadran en la misma entidad).
Bibliografía:
Cheah, Pathology 2014
Doyle, Mod Pathol 2014
Vogels, Diag Pathol 2014
jueves, 30 de abril de 2015
SOX10.
- Qué es: Factor de transcripción nuclear expresado en células de la cresta neural: crucial para la diferenciación de las células de Schwann y los melanocitos.
- Tinción: NUCLEAR.
- Expresión NORMAL: Melanocitos, células de Schwann, células mioepiteliales (de glándulas salivales, glándulas sudoríparas ecrinas y de la mama), algunas células secretoras de glándulas ecrinas, algunas células lobulillares de la mama, glía (sobre todo oligodendrocitos), tinción citoplasmática de mastocitos.
- Tumores:
- Nevus: todos los tipos: azul, neurotizado, displásico, capsular, Spitz,...
- Melanomas: incluyendo epitelioides, fusocelulares y desmoplásicos (98%), metastásicos,...
- Otros: tumor de células granulares, schwannoma, neurofibroma, tumores malignos de la vaina del nervio periférico (49%), mioepitelioma, sarcoma de células claras, algunos carcinomas ductales mama (16.5%, concretamente los triple negativos/desmoplásicos), gliomas (astrocitomas, oligodendrogliomas, glioblastomas), tumores de glándula salival y aislados sarcomas.
- NO TIÑE: Neurotekeoma celular, histiocitosis de células de Langerhans, perineurioma, ca escamoso fusocelular, fibroxantoma atípico, leiomiosarcoma (6.5%), ca de células de Merkel, fibroblastos e histiocitos de las cicatrices (que sí pueden expresar S100). En paragangliomas/feocromocitomas o tumores neuroendocrinos tiñe sólo las células sustentaculares (no las tumorales).
- UTILIDAD: en proliferaciones melanocíticas de la unión en pieles con intenso daño actínico, en melanoma desmoplásico, para evaluar ganglios centinela.
- Resumen: Marcador bastante específico, para tumores melanocíticos y de la vaina de nervio periférico. Es un marcador parecido a S-100 (de igual o mayor sensibilidad) y con las ventajas de ser nuclear y no teñir histiocitos (más específico, por tanto).
Bibliografía:
Ferringer, Arch Pathol Lab Med 2015
Tacha, Arch Pathol Lab Med 2015
jueves, 26 de marzo de 2015
GLUT1
* La positividad endotelial para GLUT1 está normalmente restringida a los endotelios con función de barrera sangre-tejido (es decir, cerebro y placenta).
* Aplicaciones de GLUT1:
1- En lesiones vasculares, sobre todo en edad pediátrica:
- Es NEGATIVO en las malformaciones vasculares, los granulomas piogénicos y el tejido de granulación.
- Los hemangiomas infantiles se pueden clasificar en:
:Los de aparición postnatal: GLUT 1 es POSITIVO en todas sus fases de desarrollo.
:Los congénitos: son todos GLUT1 NEGATIVOS, involucionen o no. Es decir, tanto los RICH (hemangioma congénito infantil rápidamente involutivo) como los NICH (hemangioma congénito infantil no involutivo) son NEGATIVOS para GLUT1.
OJO: hay expresión normal de GLUT1 en los hematíes (precisamente la función de GLUT1 tiene que ver con el transporte de glucosa en el eritrocito) y esta tinción de los glóbulos rojos sirve como control interno postivio de la técnica. El problema es que dificulta la valoración de la inmunorreactividad del endotelio.
2- Son GLUT1+ las células del perineuro. Los perineuromas son GLUT1 +, y con tinción más evidente que la que da el EMA: ya hay varios autores que sostienen que GLUT1 es el mejor marcador para el diagnóstico de perineuromas (mejor que EMA y claudina-1, que se usan también con este fin).
3- En uropatología, en el diagnóstico diferencial de los tumores renales que tienen células claras y papilas: tanto el carcinoma renal de células claras como el carcinoma papilar de células claras son GLUT1+, mientras que el carcinoma renal papilar es GLUT1-.
Bibliografía
Ferringer, Arch Pathol Lab Med 2015.
F Contreras. XII Curso de Dermatopatología 2009.
Ferringer, Arch Pathol Lab Med 2014.
Rumayor Piña, Head and Neck Pathol 2015.
* Aplicaciones de GLUT1:
1- En lesiones vasculares, sobre todo en edad pediátrica:
- Es NEGATIVO en las malformaciones vasculares, los granulomas piogénicos y el tejido de granulación.
- Los hemangiomas infantiles se pueden clasificar en:
:Los de aparición postnatal: GLUT 1 es POSITIVO en todas sus fases de desarrollo.
:Los congénitos: son todos GLUT1 NEGATIVOS, involucionen o no. Es decir, tanto los RICH (hemangioma congénito infantil rápidamente involutivo) como los NICH (hemangioma congénito infantil no involutivo) son NEGATIVOS para GLUT1.
OJO: hay expresión normal de GLUT1 en los hematíes (precisamente la función de GLUT1 tiene que ver con el transporte de glucosa en el eritrocito) y esta tinción de los glóbulos rojos sirve como control interno postivio de la técnica. El problema es que dificulta la valoración de la inmunorreactividad del endotelio.
2- Son GLUT1+ las células del perineuro. Los perineuromas son GLUT1 +, y con tinción más evidente que la que da el EMA: ya hay varios autores que sostienen que GLUT1 es el mejor marcador para el diagnóstico de perineuromas (mejor que EMA y claudina-1, que se usan también con este fin).
3- En uropatología, en el diagnóstico diferencial de los tumores renales que tienen células claras y papilas: tanto el carcinoma renal de células claras como el carcinoma papilar de células claras son GLUT1+, mientras que el carcinoma renal papilar es GLUT1-.
Bibliografía
Ferringer, Arch Pathol Lab Med 2015.
F Contreras. XII Curso de Dermatopatología 2009.
Ferringer, Arch Pathol Lab Med 2014.
Rumayor Piña, Head and Neck Pathol 2015.
martes, 17 de marzo de 2015
Catepsina K.
Marcador poco extendido aunque su uso es "fuertemente recomendado" por la ISUP (International Society of Urological Pathology).
Es una cisteín proteasa que se expresa en osteoclastos normales. El factor de transcripción de la microftalmía (MiTF), que activa genes relacionados con la producción de melanina, se une a elementos del promotor de catepsina K.
La catepsina K se sobreexpresa en los PEComas.
Es útil en patología tumoral del riñón en dos situaciones:
1.-Porque se expresa en todas las variantes de angiomiolipoma ( y en mayor número de células que las que se tiñen para HMB-45 o Melan-A).
2.- Para ayudar al diagnóstico de los carcinomas asociados a translocación (MiTF/TFE) que también suelen ser catepsina K +. De los dos subtipos más frecuentes en esta familia:
- Los tumores con translocaciones en Xp11 (o TFE3+): virtualmente todos tienen tinción citoplasmática difusa para catepsina K.
- Los asociados con t(6;11) (o TFEB+): son también positivos, aunque no todos.
(Nota: como se ve, tanto el angiomiolipoma epiteliode como el carcinoma asociado a translocación pueden ser positivos para marcadores melanocíticos y catepsina K: para diferenciarlos, aparte de la histología, desde el punto de vista IHQ estarían los marcadores musculares, positivos en el primero, frente a la AC IX y la racemasa que se expresan en el segundo: en algún caso o generalmente, respectivamente).
Bibliografía:
Wilkerson. Arch Pathol Lab Med 2014.
Reuter. Am J Surg Pathol 2014.
Es una cisteín proteasa que se expresa en osteoclastos normales. El factor de transcripción de la microftalmía (MiTF), que activa genes relacionados con la producción de melanina, se une a elementos del promotor de catepsina K.
La catepsina K se sobreexpresa en los PEComas.
Es útil en patología tumoral del riñón en dos situaciones:
1.-Porque se expresa en todas las variantes de angiomiolipoma ( y en mayor número de células que las que se tiñen para HMB-45 o Melan-A).
2.- Para ayudar al diagnóstico de los carcinomas asociados a translocación (MiTF/TFE) que también suelen ser catepsina K +. De los dos subtipos más frecuentes en esta familia:
- Los tumores con translocaciones en Xp11 (o TFE3+): virtualmente todos tienen tinción citoplasmática difusa para catepsina K.
- Los asociados con t(6;11) (o TFEB+): son también positivos, aunque no todos.
(Nota: como se ve, tanto el angiomiolipoma epiteliode como el carcinoma asociado a translocación pueden ser positivos para marcadores melanocíticos y catepsina K: para diferenciarlos, aparte de la histología, desde el punto de vista IHQ estarían los marcadores musculares, positivos en el primero, frente a la AC IX y la racemasa que se expresan en el segundo: en algún caso o generalmente, respectivamente).
Bibliografía:
Wilkerson. Arch Pathol Lab Med 2014.
Reuter. Am J Surg Pathol 2014.
Anhidrasa Carbónica IX ( AC IX)
Es un marcador asociado directamente a la histogénesis del carcinoma renal de células claras (CRCC). Por ello la AC IX se encuentra sobreexpresada virtualmente en todos los CRCC, con un patrón de tinción membranoso, aunque la positividad puede ser focal o difusa.
(OJO: no es específica de origen renal, por ejemplo: algunos carcinomas uroteliales son AC IX+).
Para valorar la tinción hay que tener en cuenta dos cosas:
Considerar sólo la tinción de membrana, no la citoplasmática.
No se debe evaluar en zonas de la neoplasia adyacentes a áreas de necrosis, porque cualquier tumor en situación de hipoxia puede sobreexpresar AC IX.
Utilidad: Puede ayudar a diferenciar el CRCC de otros tipos histológicos, sobre todo en variantes raras (por ejemplo carcinomas sarcomatoides).
Es NEGATIVA en otros tumores epitelioides de células claras que entrarían en el diagnóstico diferencial con el CRCC, como el carcinoma cromófobo o el angiomiolipoma epitelioide. En los carcinomas de translocación (familia MiTF-TFE) puede haber positividad focal, aunque muchos son AC IX negativos. Los carcinomas papilares de células renales son negativos (tanto el tipo 1 como el 2), aunque puede haber tinción focal, como en la punta de las papilas. El carcinoma de ductos colectores es AC IX negativo.
Una aplicación especial de este marcador es en el diagnóstico del carcinoma papilar de células claras, que muestra positividad difusa, pero con un patrón de tinción peculiar: en la membrana basal y lateral siendo negativo el polo apical: tinción "en copa" (a diferencia del CRCC usual, en el que se tiñe todo el contorno de la membrana).
Bibliografía:
Wilkerson. Arch Pathol Lab Med 2014.
Reuter. Am J Surg Pathol 2014.
miércoles, 18 de febrero de 2015
OCT4
Marcador nuclear, muy sensible y específico de tumores de células germinales. En los algoritmos de la ISUP se recomienda como el primer paso para tipificar estos tumores: es positivo en seminomas clásicos y carcinomas embrionarios; es negativo en tumores del saco vitelino, tumor espermatocítico y coriocarcinoma.
Es positivo en la neoplasia intratubular de células germinales.
Aparte de la tinción nuclear puede haber también positividad puntiforme en el citoplasma.
También sirve para el diagnóstico diferencial con tumores de cordones sexuales/estroma, que son negativos para OCT4.
Nistal comentó alguna vez que puede haber problemas de tinción con este marcador en testículos fijados en Bouin.
Puede haber tinción citoplasmática con OCT4 en tumores neuroendocrinos y feocromocitomas.
Las ventajas de OCT4: mejor relación señal/fondo que la PLAP (seminomas,…) y mayor sensibilidad que CD30 para el carcinoma embrionario (sobre todo después de quimioterapia, donde frecuentemente se pierde la reactividad para CD30).
En el testículo normal postpuberal es negativo en las espermatogonias. Por ello es útil como marcador de neoplasia intratubular (al igual que D2-40) diferenciándola de gonias no neoplásicas. (SALL4 y ckit pueden marcar también gonias normales, por lo que no son fiables para diferenciar gonias normales de neoplasia intratubular de células germinales. Algunos autores no consideran tampoco completamente seguro PLAP aunque es más positivo en las células neoplásicas que en las gonias normales).
Bibliografía:
Lin & Liu. Arch Pathol Lab Med 2014.
Wilkerson. Arch Pathol Lab Med 2014.
www.nordiqc
Siegmund. Hum Pathol 2022.
SALL4
Marcador de tumores de células germinales: se expresa en todos los tipos (seminomas, carcinomas embrionarios, tumores del saco vitelino, coriocarcinomas) y orígenes (testículo, ovario, mediastino, SNC). SALL4 es positivo también en la neoplasia intratubular de células germinales y en el tumor espermatocítico (este último es negativo para PLAP y OCT4). En teratomas se puede expresar en el epitelio escamoso y de tipo intestinal.
Es negativo, sin embargo, en los tumores de cordones sexuales-estroma.
Sus ventajas: es un marcador nuclear y su sensibilidad, prácticamente del 100%.
Inconveniente: aunque es bastante específico, se ha descrito positividad en otros tumores: 89% carcinomas gástricos hepatoides, 58% hepatoblastomas, 88% tumores rabdoides malignos, 50% tumores de Wilms, 94% hepatocarcinomas, y casos aislados de adenocarcinomas de colon, esófago, ovario (incluyendo carcinoma de células claras), endometrio, endocérvix. Por ello es aconsejable usarlo en conjunto con otros marcadores, como OCT4, como marcadores de tumores germinales.
En el testículo normal, hay positividad débil SALL4 en las espermatogonias. Por ello NO se recomienda este marcador para el diagnóstico de neoplasia intratubular (mejores para este fin, OCT4 y D2-40). (ckit también puede marcar gonias normales, por lo que tampoco es fiable para diferenciar gonias normales de neoplasia intratubular de células germinales, y PLAP no se considera seguro por algunos autores para ese fin).
Lin & Liu. Arch Pathol Lab Med 2014.
Wilkerson. Arch Pathol Lab Med 2014.
Kaspar. Arch Pathol Lab Med 2014.
Siegmund. Hum Pathol 2022.
jueves, 15 de enero de 2015
NKX3.1
La expresión de NKX3.1 sirve como indicador de origen prostático (no para diferenciar benignidad de malignidad). Es un marcador con elevada sensibilidad (98.6% de carcinomas prostáticos metastásicos) y especificidad (se ha descrito en: próstata normal y neoplásica, testículo normal, y en carcinomas poco habituales en el varón: 5-9% de carcinomas ductales de mama, y 26-27% de carcinomas lobulillares de mama) PSA y fosfatasa ácida prostática (PSAP) se expresan en menor extensión en carcinomas prostáticos metastásicos y, por otra parte, se pueden encontrar en algunos tumores no prostáticos (PSA en carcinomas de mama y de glándula salival, y PSAP en carcinoides). Otra ventaja del NKX3.1 es que la expresión de este marcador es nuclear. Puede haber tinción citoplasmática débil o moderada pero sólo la nuclear se valora como positividad.
Bibliografía:
Gurel 2010 (AJSP) y Wilkerson 2014 (Arch Pathol Lab Med)
Bibliografía:
Gurel 2010 (AJSP) y Wilkerson 2014 (Arch Pathol Lab Med)
S100P
Miembro de la familia de proteínas S100. Se identificó por primera vez en la placenta (de ahí viene la P). Es un marcador relativamente nuevo, aún poco utilizado.
-El patrón de tinción es nuclear + citoplasmático, o nuclear sólo.
-PRINCIPALES USOS:
1* Diferenciar malignidad vs benignidad en lesiones pancreatobiliares.
2* Marcador de origen urotelial ante una neoplasia del tracto urogenital.
1- LESIONES PANCREATICOBILIARES:
-En el páncreas: es positiva en la mayoría de los adenocarcinomas ductales mientras que suele ser negativa o sólo citoplasmática en los ductos normales o reactivos, y acinos. También se expresa en la neoplasia mucinosa papilar intraductal.
Es negativa en otros tumores de páncreas (neoplasia endocrina pancreática, carcinoma de células acinares, neoplasia sólida pseudopapilar).
Su utilidad, para diagnóstico de malignidad, aumenta si se usa en un panel conjuntamente con otros marcadores, que varían según diferentes autores: maspina, pVHL, KOC, mesotelina, MUC-1, IMP-3,…. .
2-También es un marcador muy sensible y específico de UROTELIO. (Y es negativa en el carcinoma renal por lo que sirve para diferenciarlos: por ej ca ductos colectores vs. Ca urotelial).
OJO:
-No es específico de esos dos orígenes: S100P se puede expresar en otros tipos de carcinoma (10%–62%), incluyendo tracto gastrointestinal, pulmón y ovario.
Bibliografía:
-Libro Lin y Prichard 2011
-Truong2011 (IHQ en ca renal)
-Mohanty 2014
-Amin2014 (Best practices)
-El patrón de tinción es nuclear + citoplasmático, o nuclear sólo.
-PRINCIPALES USOS:
1* Diferenciar malignidad vs benignidad en lesiones pancreatobiliares.
2* Marcador de origen urotelial ante una neoplasia del tracto urogenital.
1- LESIONES PANCREATICOBILIARES:
-En el páncreas: es positiva en la mayoría de los adenocarcinomas ductales mientras que suele ser negativa o sólo citoplasmática en los ductos normales o reactivos, y acinos. También se expresa en la neoplasia mucinosa papilar intraductal.
Es negativa en otros tumores de páncreas (neoplasia endocrina pancreática, carcinoma de células acinares, neoplasia sólida pseudopapilar).
Su utilidad, para diagnóstico de malignidad, aumenta si se usa en un panel conjuntamente con otros marcadores, que varían según diferentes autores: maspina, pVHL, KOC, mesotelina, MUC-1, IMP-3,…. .
2-También es un marcador muy sensible y específico de UROTELIO. (Y es negativa en el carcinoma renal por lo que sirve para diferenciarlos: por ej ca ductos colectores vs. Ca urotelial).
OJO:
-No es específico de esos dos orígenes: S100P se puede expresar en otros tipos de carcinoma (10%–62%), incluyendo tracto gastrointestinal, pulmón y ovario.
Bibliografía:
-Libro Lin y Prichard 2011
-Truong2011 (IHQ en ca renal)
-Mohanty 2014
-Amin2014 (Best practices)
p57 y mola
p57: Marcador nuclear. El gen se expresa preferentemente en el alelo materno. En este tema, su utilidad: para reconocer molas completas (que son p57- en el 99.5% de los casos porque son puramente androgenéticas). No sirve para diferenciar molas parciales (casi siempre p57+) de abortos hidrópicos sin más (p57+).
IHQ: HAY QUE VALORAR:
1-Control interno de la técnica.
2-Resultado: ¿+ o - en las células del estroma vellositario y en las de citotrofoblasto?; ¿es discrepante entre ambos tipos de céls?; ¿resultados distintos entre distintas vellosidades?.
PATRONES DE TINCIÓN:
• Control interno (siempre se deben teñir): Son positivos decídua y/o trofoblasto intermedio (islas de trofoblasto intervelloso). (Sincitio es negativo).
• Resultado +: positividad en >10% de las células del estroma vellositario y citotrofoblasto (además del control int +).
• Resultado -: células del estroma vellositario y citotrofoblasto negativas (o positividad en menos del 10%). Con una morfología adecuada, es compatible con MOLA COMPLETA.
• Resultado discordante: En una vellosidad células del estroma vellositario positivas y citotrofoblasto negativo, o viceversa. Puede corresponder en algunos casos a quimeras o mosaicos.
• Resultado divergente: Dos poblaciones de vellosidades con diferente inmunofenotipo (por ej por mosaico emb molar y no molar).
ALGORITMO DG:
1:¿Cuándo hacer p57?
• Sospecha anatomopatológica: morfología anómala de las vellosidades.
O por
• Sospecha clínica: aumento anormal de betaHCG, ECO anormal, si nos remiten petición como “a descartar mola”.
2:p57 negativa >>>> mola completa (fin del estudio).
- EXCEPTO si son molas recurrentes: hay que seguir con genotipado molecular (para descartar la posibilidad de que sea hereditaria, por ciertas mutaciones genéticas).
3:p57 positiva o tinción IHQ no satisfactoria: hay que completar el estudio con genotipado molecular, que será lo que permita diferenciar mola parcial de embarazo no molar.
* (Si no se dispone de la técnica de genotipado molecular, se sugiere usar un diagnóstico del siguiente estilo: “Morfología vellosa anormal, no se puede excluír mola hidatídica parcial”).
4:Tinción discordante o divergente: hay que completar el estudio con genotipado molecular, para descartar la posibilidad de mosaico o embarazo quimérico.
IHQ: HAY QUE VALORAR:
1-Control interno de la técnica.
2-Resultado: ¿+ o - en las células del estroma vellositario y en las de citotrofoblasto?; ¿es discrepante entre ambos tipos de céls?; ¿resultados distintos entre distintas vellosidades?.
PATRONES DE TINCIÓN:
• Control interno (siempre se deben teñir): Son positivos decídua y/o trofoblasto intermedio (islas de trofoblasto intervelloso). (Sincitio es negativo).
• Resultado +: positividad en >10% de las células del estroma vellositario y citotrofoblasto (además del control int +).
• Resultado -: células del estroma vellositario y citotrofoblasto negativas (o positividad en menos del 10%). Con una morfología adecuada, es compatible con MOLA COMPLETA.
• Resultado discordante: En una vellosidad células del estroma vellositario positivas y citotrofoblasto negativo, o viceversa. Puede corresponder en algunos casos a quimeras o mosaicos.
• Resultado divergente: Dos poblaciones de vellosidades con diferente inmunofenotipo (por ej por mosaico emb molar y no molar).
ALGORITMO DG:
1:¿Cuándo hacer p57?
• Sospecha anatomopatológica: morfología anómala de las vellosidades.
O por
• Sospecha clínica: aumento anormal de betaHCG, ECO anormal, si nos remiten petición como “a descartar mola”.
2:p57 negativa >>>> mola completa (fin del estudio).
- EXCEPTO si son molas recurrentes: hay que seguir con genotipado molecular (para descartar la posibilidad de que sea hereditaria, por ciertas mutaciones genéticas).
3:p57 positiva o tinción IHQ no satisfactoria: hay que completar el estudio con genotipado molecular, que será lo que permita diferenciar mola parcial de embarazo no molar.
* (Si no se dispone de la técnica de genotipado molecular, se sugiere usar un diagnóstico del siguiente estilo: “Morfología vellosa anormal, no se puede excluír mola hidatídica parcial”).
4:Tinción discordante o divergente: hay que completar el estudio con genotipado molecular, para descartar la posibilidad de mosaico o embarazo quimérico.
Suscribirse a:
Comentarios (Atom)